Valves épaisses et solides, 2,5 à 6 cm de longueur
Périostracum lisse gris-brun
Coquille équivalve, inéquilatérale
Sommets recourbés vers l’avant
Deux dents cardinales formant un Λ
Surface supérieure de la dent latérale postérieure striée transversalement
Atlantic rangia, common rangia, wedge clam, gulf wedge clam, cocktail clam (GB), Almeja gallo (E), Die Brackwassertrogmuschel (D), De amerikaanse brakwaterstrandschelp (NL)
Gnathodon cuneatus G. B. Sowerby I, 1832
Rangia cyrenoides Des Moulins, 1832 ou Desmoulins, 1832
Gnathodon cuneatus var. nasutus Dall, 1884
Gnathodon nasutus Dall, 1884
Caraïbes, Atlantique Nord-Ouest, Atlantique Nord-Est
Zones DORIS : ● Europe (côtes françaises), ● Atlantique Nord-Ouest, ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Rangia cuneata est originaire du golfe du Mexique. Elle a été introduite sur la côte atlantique de l’Amérique du Nord, de la côte est de la Floride (1960) à l’embouchure de la rivière Hudson (1988), puis en Europe à partir de 2005. Elle est présente en mer Baltique et dans de nombreux estuaires de la mer du Nord et en Manche.
Rangia cuneata s’enfouit dans les fonds vaseux et sablonneux des estuaires, le plus souvent dans des zones où la salinité est comprise entre 0 et 10 ‰ . Les adultes peuvent supporter jusqu’à 33 ‰ mais la compétition et la prédation peuvent restreindre cette espèce aux eaux saumâtres. En Floride par exemple, cette espèce est absente au-dessus de 16 ‰. Elle tolère des températures de 0 °C à 33 °C et peut supporter des conditions anoxiques* mais ne supporte pas l’émersion.
La combinaison d’une faible salinité, d’une turbidité élevée et d’un substrat mou de sable, de boue et de végétation semble être l’habitat le plus favorable.
Rangia cuneata possède des valves* épaisses et solides de 2,5 à 6 cm de longueur, avec un périostracum* assez lisse et gris brun. La coquille est équivalve*, inéquilatérale* avec les sommets recourbés vers l’avant. La section transversale de la coquille intacte est en forme de cœur. Les stries d’accroissement sont fines et régulières.
Les deux valves ont deux dents cardinales* formant une projection en forme de Λ. La surface supérieure de la dent latérale postérieure est striée transversalement. Le ligament externe est absent ou invisible, mais le ligament interne, brun foncé, se trouve dans une fossette triangulaire profonde, immédiatement en dessous et en arrière des sommets.
L’intérieur de la coquille est blanc brillant. Le sinus* palléal* est petit. La ligne palléale est fine.
Les siphons* assez courts sont blancs et soudés sur leur longueur. Tous les deux sont bordés par une ligne sombre à leur extrémité. Au-dessus, le siphon inhalant* porte une couronne de fins tentacules*. Le siphon exhalant* porte de très nombreux petits tentacules.
Rangia flexuosa ou rangia brune. Cette espèce, beaucoup moins commune, semble confinée au golfe du Mexique de Louisina au Texas à Vera Cruz au Mexique. Elle mesure 2,5 à 4 cm de longueur et ressemble à une R. cuneata allongée. Cette espèce n’a pas de sinus* palléal*. La dent latérale postérieure est courte (celle de R. cuneata est longue).
Macoma balthica peut ressembler à des spécimens inférieurs à 10 mm de longueur de coquille de R. cuneata, mais la coquille est mince, le crochet n’est pas recourbé vers l’avant et les deux dents cardinales ne forment pas un « V » renversé.
Les spisules comme S. subtruncata ne possèdent pas une coquille robuste, ni de sommet recourbé, ni de sinus palléal bien visible et S. subtruncata ne vit pas en eaux peu salées.
Mulinia lateralis ressemble à R. cuneata juvénile, mais chez M. lateralis, les dents latérales ne sont pas crénelées.
Rangia cuneata est un filtreur* suspensivore* non sélectif qui se nourrit de micro-algues du phytoplancton*, de bactéries comme de débris végétaux. Cette espèce serait capable d’assimiler la matière organique des sédiments.
Les particules en excès ou non comestibles sont rejetées sous forme de pseudo-fèces*.
Les sexes sont séparés et moins de 2 % peuvent être hermaphrodites*. Les adultes sont matures pour une taille de 14 à 25 mm au cours de la deuxième ou troisième année, voire la première année.
La formation des gamètes* commence lorsque la température de l’eau atteint 15 °C ou une baisse de la salinité (environ 5 ‰). La plupart des populations peuvent se reproduire deux fois par an. Les ovules* et les spermatozoïdes* sont libérés dans l’eau où la fécondation* a lieu.
Les larves* trochophores*, jaune foncé, éclosent après 24 h et en une dizaine d’heures, elles se transforment en véligères* (160 µm), puis pédivéligères*.
Au bout d’une semaine, elles se métamorphosent* en juvéniles (170 µm de long) qui s’installent dans des sédiments sableux. Les adultes préfèrent des sédiments vaseux.
Une salinité de 2,5 à 14 ‰ est nécessaire pour la reproduction et l’installation des larves et d'une température de 8 à 32 °C.
La durée de vie des adultes est de 4 à 8 ans (avec un maximum d’environ 15 ans).
Des populations de 4 000 individus par m² ont été observées.
En Atlantique Ouest, d’autres mollusques bivalves sont présents comme Polymesoda caroliniana (Bosc, 1801), Mytilopsis leucophaeta (Conrad, 1831), Ameritella mitchelli (Dall, 1895), Ischadium recurvum (Rafinesque, 1820) et plus rarement Utterbackia imbecilis (Say, 1829). Dans cet écosystème, on trouve également des annélides polychètes comme Marenzelleria viridis (Verrill, 1873), Laeonereis cuvieri (Webster, 1879) et des arthropodes tels Cyathura polita (Stimpson, 1855), Apocorophium lacustre (Vanhöffen,1911) et Gammarus sp.
Rangia cuneata est l’hôte de larves* d’endoparasites*, des Trématodes, des cercaires comme Cercaria rangiae Wardle, 1983, et Prosorhynchoides extenuatus Curran & Calhoun in Curran, Calhoun, Tkach, Warren & Bullard, 2022 et certains sporocystes de trématodes. Seuls les individus de grande taille seraient infectés.
Les gonades* peuvent être parasitées par des larves de trématodes (famille de Fellodistomatidae) qui peuvent castrer leurs hôtes. Les branchies* et les gonades sont habités par le cilié Ancystrum mytili (Quennerstedt, 1867) ; l’épithélium du pied et les parties adjacentes par le cilié Peniculistoma mytili (De Morgan, 1925) et par des parasites de la moule Mytilus edulis.
Il existe donc une menace d’introduction de nouvelles espèces de parasites associés à l’invasion de Rangia cuneata en Europe.
Les coquilles, solides, peuvent être le support d’épifaune*.
Rangia cuneata possède des mécanismes d’osmorégulation extracellulaires (sang et fluides corporels) et intracellulaires qui lui permettent de franchir l’« holohalicinum », la limite de salinité de 5 à 8 ‰ qui sépare habituellement les invertébrés d’eau douce de ceux d’eau salée. De ce fait, elle est une des rares espèces qui peut se développer au-delà des limites séparant les eaux douces des eaux salées, ce qui lui permet de proliférer dans des zones habituellement défavorables à de nombreuses espèces animales.
La compétition et la prédation peuvent expliquer sa rareté dans des environnements à forte salinité.
Les jeunes de l'espèce ont une tolérance à la salinité beaucoup plus faible que les adultes ; c'est ce facteur, combiné à ceux de la compétition interspécifique* et de la prédation, qui limite l'espèce au sein des estuaires à une gamme de salinité beaucoup plus faible que celle des adultes.
Lorsque la salinité et la température sont basses, Rangia cuneata peut fermer sa coquille. Elle utilise alors un métabolisme anaérobie* (jusqu’à deux semaines).
Rangia cuneata, sur la côte atlantique nord-ouest est la proie d’un large éventail de prédateurs comme des crabes (par exemple le crabe bleu Callinectes sapidus qui semble préférer les individus de 1 à 2 cm de long à 2 à 3 cm), Rhithropanopaeus harrissii, des crevettes de rivière Macrobrachium spp., de 2 gastéropodes (Polinices spp., Stramonita haemastoma)), de nombreux poissons (au moins 17 espèces) comme Ictalurus furcatus, Leiostomus xanthurus, Micropogonias undulatus, Pogonias cromis, Aplodinius grunnieus, de 8 oiseaux aquatiques comme des canards plongeurs fuligules milouinan Aythya marila et Aythya affinis, Anas rubripes, fuligule à collier Aythya collaris et du colvert Anas platyrhynchos, de l’érismature rousse Oxyura jamaicensis, des ratons-laveurs (Procyon lotor) et des loutres (Lontra canadensis).
En baie de Seine, canal de Caen à la mer (bassin de Hérouville -14), la consommation de Rangia cuneata par le goéland argenté Larus argentatus et la loutre d'Europe Lutra lutra a été observée.
Rangia cuneata est présent dans les sédiments du Pliocène (- 5 à - 2 millions d'années) dans les Etats des Carolines et en Floride aux Etats-Unis.
Jusqu’au milieu du 20ème siècle, cette espèce était considérée comme éteinte depuis le pleistocène (- 2,58 millions d'années à - 11 700 ans) le long de la côte atlantique ouest et ne vivait que dans les estuaires de la côte du golfe du Mexique.
Rangia cuneata a été découverte pour la première fois en Belgique, en 2005, dans l’estuaire de l’Escaut. Elle obstruait les tuyaux d’entrée d’eau de refroidissement d’une centrale électrique près d’Anvers. Des auteurs estiment que son arrivée devait remonter à 1999 ou 2000.
Elle a ensuite été observée en plusieurs endroits en Belgique et aux Pays-Bas. Elle a progressivement colonisé la mer Baltique (2000-2010), en 2013 la côte sud allemande, puis en 2015 le Lincolnshire (Royaume-Uni).
L’espèce a été signalée pour la première fois le long des rives du canal de Caen à la mer à Benouville – Ranville le 9 août 2017 (Kerckhof et al., 2017). Sa présence et son établissement ont été confirmés à partir d’observations à Ouistreham. Plus récemment, une petite population a été observée en Brière, suggérant que l’espèce est probablement déjà largement plus répandue en métropole qu’on ne le pense.
Son introduction en Europe est liée au transport maritime, les larves étant disséminées par les eaux de ballast.
Rangia cuneata a été consommée par les populations amérindiennes et peut être consommée fraîche ou en conserves dans le New Jersey, au Texas, en Caroline du Nord et au Mexique ou encore utilisée comme appâts pour la capture des crabes bleus (Callinectes sapidus).
Les accumulations de coquilles, sur la côte de l’Atlantique Ouest, sont également une source importante de matériaux pour la construction de routes et la production de plusieurs produits industriels (chaux, additifs alimentaires pour la nourriture des volailles, …).
Aux Etats-Unis, des concentrations importantes de chlordécone (insecticide de synthèse, toxique, non biodégradable) ont été mesurées dans la chair de cette espèce qui semble accumuler les polluants.
Rangia d’Atlantique: simple traduction du nom anglais.
Rangia : ce nom de genre est dédié au naturaliste et malacologue français Paul Charles Léonard Alexandre (Sander) Rang des Adrets (1793-1844), survivant du naufrage de la Méduse (juillet 1816) et gouverneur d’Alger puis de Nosy Be (Madagascar) et de Mayotte par le botaniste et malacologue français Charles Robert Alexandre des Moulins (1798-1875). Les premiers spécimens venaient du lac Pontchartrain (près de la Nouvelle-Orléans) comme ceux décrits par G.B. Sowerby en 1832.
cuneata : du latin [cuneatus] = qui à la forme d’un coin. Ce nom d’espèce a été donné par le malacologue britannique George Brettingham Sowerby 1(1788-1854) (1 car c’est la première génération ; il y en a eu trois avec les mêmes prénoms). Il avait reçu des spécimens provenant du lac Pontchartrain (près de la Nouvelle-Orléans).
Numéro d'entrée WoRMS : 156991
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Bivalvia / Lamellibranchia / Pelecypoda | Bivalves / Lamellibranches / Pélécypodes | Mollusques aquatiques, filtreurs, au corps comprimé latéralement. Coquille composée de 2 valves articulées disposées de part et d’autre du plan de symétrie. Absence de tête, de pharynx, de radula et de glande salivaire. |
| Sous-classe | Autobranchia | Autobranches | |
| Infra-classe | Heteroconchia | Hétéroconchie | |
| Subter-classe | Euheterodonta | Euhétérodonte | |
| Super ordre | Imparidentia | Imparidenties | |
| Ordre | Venerida | Vénérides | Coquille mince, allongée, dure et costulée, bâillante à une ou aux deux extrémités. Ligament à la fois interne et externe. |
| Super-famille | Mactroidea | ||
| Famille | Mactridae | Mactridés | Coquille équivalve, mince, porcelanée. Charnière à dents principales en forme de V. Ligament externe avec resilium, logé dans un chondrophore. Siphons entièrement ou partiellement unis. Sinus palléal arrondi, profond. Pas de byssus. |
| Sous-famille | Mactrinae | Mactrinés | |
| Genre | Rangia | ||
| Espèce | cuneata |
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Vue latérale gauche
Le périostracum* est bien visible ainsi que les sommets recourbés vers l'avant.
Watergang du Plein Fossé, Calais (62)
23/03/2025
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Vue latérale droite
Le périostracum* et le sommet recourbé vers l'avant sont bien visibles.
Watergang du Plein Fossé, Calais (62)
23/05/2025


Vue des sommets
Les sommets sont bien écartés.
Watergang du Plein Fossé, Calais (62)
23/05/2025


Vue de l'intérieur de la valve gauche
La coquille est épaisse.
Watergang du Plein Fossé, Calais (62)
23/03/2025
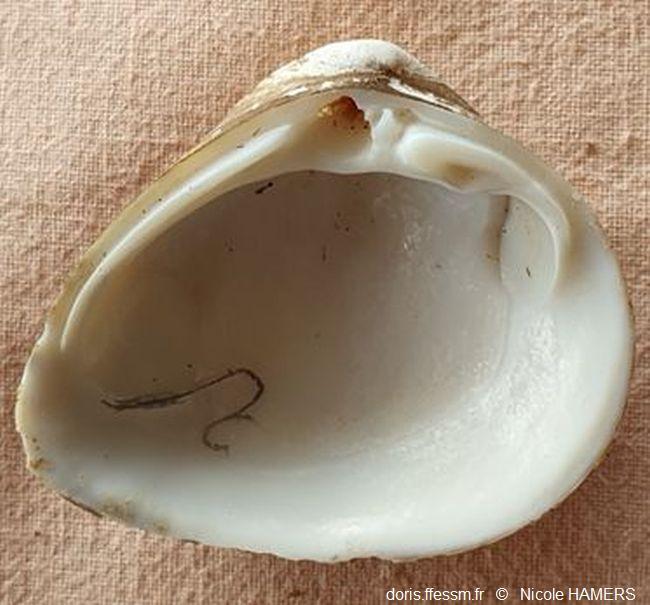
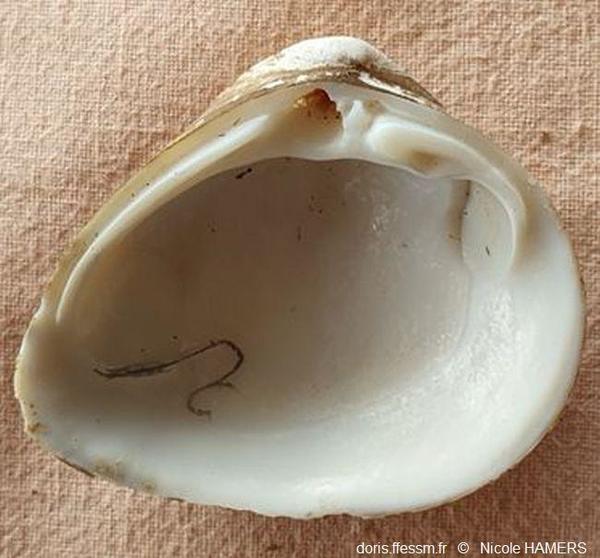
Intérieur de la valve gauche
Le sinus* palléal* a été souligné.
Bénouville (76)
18/03/ 2025


Vue de l'intérieur de la valve droite
La coquille est épaisse.
Watergang du Plein Fossé, Calais (62)
23/05/2025
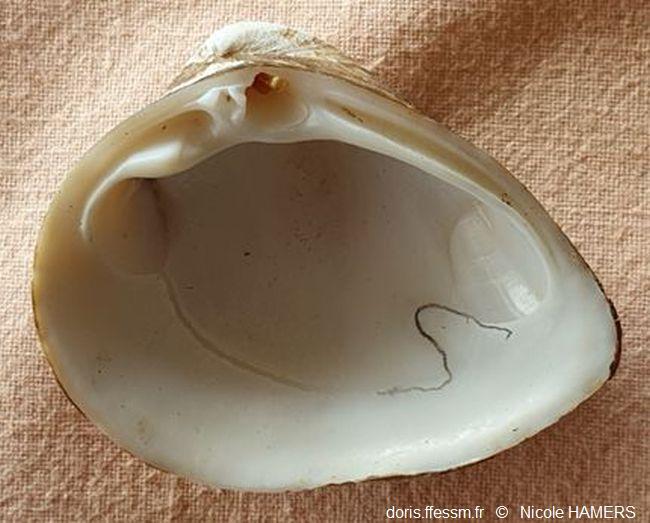
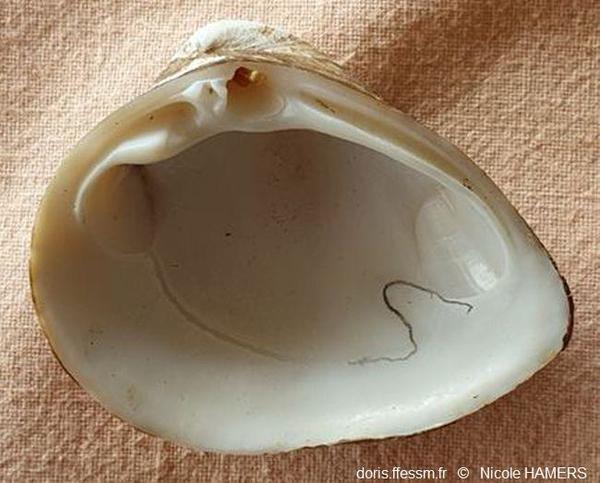
Intérieur de la valve droite
Le sinus* palléal* a été souligné.
Bénouville (76)
18/03/2025



Premier spécimen
Premier spécimen récolté à Bénouville.
Canal de Caen à la mer Bénouville (14)
09/08/2017
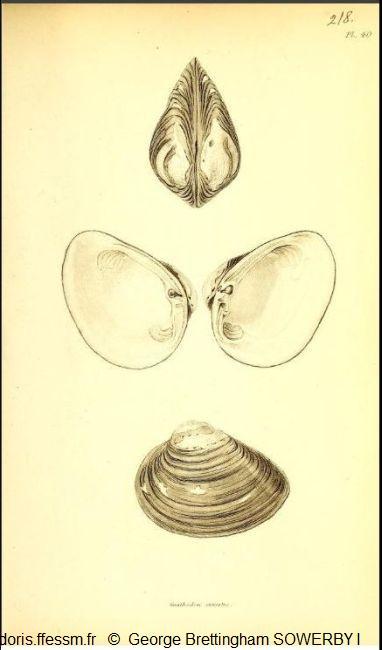
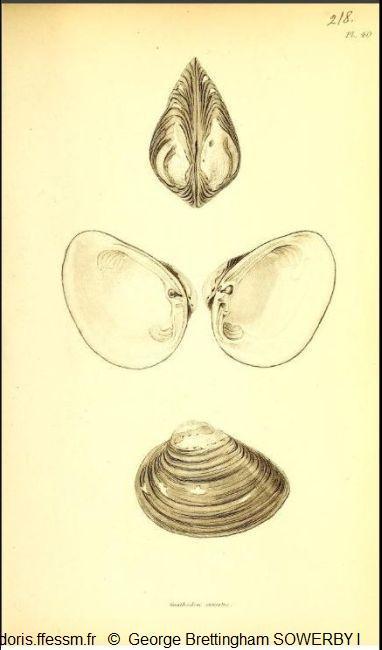
Première représentation
En haut : vue de dessus,
Au milieu : valve gauche et valve droite,
En bas : vue latérale de la valve gauche.
Planche 218, volume 2, G.B. Sowerby 1, 1825-1834
Reproduction de documents anciens
1832


Planche de des Moulins
Fig 1 : la coquille vue à l’extérieur et du côté de la valve gauche
Fig 2 : charnière de la valve droite
Fig 3 : charnière de la valve gauche
Sur ces deux figures, comme chez tous les individus, on voit très nettement le ligament très noir, fixé dans sa fossette, à laquelle chacune des moitiés adhère très fortement.
Des Moulins 1832, p59, dessins de Melle Aline Alaux
Reproduction de documents anciens
1832
Rédacteur principal : Yves MÜLLER
Vérificateur : Philippe LE GRANCHÉ
Responsable régional : Yves MÜLLER
Bock G., Lieberum C., Schütt R., Wiese V., 2015, Erstfund der brackwassermuschel Rangia cuneata in Deutschland (Bivalvia: Mactridae), Schriften zur Malakologie, 28, 13-16.
Cain T. D., 1972, The reproductive cycle and larval tolerances of Rangia cuneata in the James River, Virginia, Dissertations, Theses, and Masters Projects, William & Mary, Paper 1627407610.
Chanley P.E.,1965, Larval development of the mactrid clam, Rangia cuneata, Chesapeake Science, 6(4), 209-213.
Cooper R.B., 1981, Salinity tolerance of Rangia cuneata (Pelecypoda:Mactridae) in relation to its estuarine environment: A review, Walkerana,1,19-31.
Ebersole E.L., Kennedy V.S., 1994, Size selection of Atlantic Rangia clams, Rangia cuneata, by blue crabs, Callinectes sapidus, Estuaries,17, 668-673.
Faillettaz R., Roger C., Mathieu M., Robin J., Costil K.. 2020. Establishment and population features of the non-native Atlantic rangia, Rangia cuneata (Mollusca: Bivalvia), in northwestern France, Aquatic Invasions, 15 (3), 67-381.
Kerckhof F., Devleeschouwer M., Hamers N., 2017, De Amerikaanse brakwaterstrandschelp Rangia cuneata (G. B. Sowerby, 1832) aangetroffen in Frankrijk, De Strandvlo, 37, 141–145.
Kerckhof F., Haelters J., Gollasch S., 2007, Alien species in the marine and brackish ecosystem: the situation in Belgian waters, Aquatic Invasions, 2(3), 243-257.
La Salle M.W., Cruz A.A. de la, 1985, Species profiles: life histories and environmental requirements of coastal fishes and invertebrates (Gulf of Mexico), common rangia, Biological Report, 82, 11-31.
Möller T., Kotta J., 2017, Rangia cuneata (G.B. Sowerby I, 1831) continues its invasion in the Baltic Sea: the first record in Pärnu Bay, Estonia, Bioinvasions Records,6 (2), 167-172.
Des Moulins C.,, 1832, Description d'un genre nouveau de coquille bivalve, Actes de la Société Linnéenne de Bordeaux, 5(4), 48-58, 1 pl.
Neckheim C.M., 2013, Verspreiding van de brackwaterstrandschelp Rangia cuneata (Sowerby I, 1831), Spirula, 391, 37-38.
Pezy J-P., Pezy A., Raoux A., 2022, The invasive species Rangia cuneata: A new food source for herring gull (Larus argentatus)?, Ecosphere, 13(4), ecs2.4058.
Prié V., Beisel J-N., 2020,La Rangia d’Atlantique, Rangia cuneata (G.B. Sowerby I., 1832), une nouvelle espèce de bivalve introduite en France,
Rudinskaya L.V., Gusev A.A., 2012, Invasion of the North American wedge clam Rangia cuneata (GB Sowerby I, 1831) (Bivalvia: Mactridae) in the Vistula Lagoon of the Baltic Sea, Russian Journal of Biological Invasions, 3, 220-229.
Sowerby I G.B., (1821-1834), The genera of recent and fossil shells, for the use of students, in conchology and geology, Published in 42 parts. Vol. 1, pls 1-126 [1821-1825]; vol. 2, pls 127-262 + text (unpaginated) [1825-1834]. London: G. B. Sowerby.
Swiezak J., Smolarz K., AliMichnowska cja., Agnieszka Swiealska2 Sobczyk; Amanda; Ryszard, Kornijów, 2021, Physiological and microbiological determinants of the subtropical non-indigenous Rangia cuneata health and condition in the cold coastal waters of the Baltic Sea: the Vistula Lagoon case study, Aquatic Invasions, 16.
Verween A., Kerckhof F., Vincx M., Degraer S., 2006, First European record of the invasive brackish water clam Rangia cuneata (G.B. Sowerby I, 1831) (Mollusca: Bivalvia), Aquatic Invasions,1, 198-203.
Willing M.J., 2015, Two invasive bivalves, Rangia cuneata (GB Sowerby I, 1831) and Mytilopsis leucophaeta (Conrad, 1831), living in freshwater in Lincolnshire, Eastern England, Journal of Conchology, 42 (2), 189-192.
Wolfe D.A., Petteway E.N., 1968, Growth of Rangia cuneata Gray, Chesapeake Science, 9(2), 99-102.
La page de Rangia cuneata dans l'Inventaire National du Patrimoine Naturel : INPN
La page de Rangia cuneata sur le site de référence de DORIS pour les mollusques :MolluscaBase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.